Prof. Rien van Oers en prof. Sonja Zweegman De twee meest voorkomende vormen van chronische leukemie, chronische lymfatische leukemie (CLL) en chronische myeloide leukemie (CML), hebben ten opzichte van acute vormen van leukemie een indolent beloop. Bij chronische lymfatische leukemie is bij aanvang vaak geen behandeling nodig en op het moment dat behandeling noodzakelijk wordt, is de behandeling vaak tijdelijk, waarna een therapievrij interval volgt. Bij chronische myeloide leukemie vindt direct behandeling met de zogenaamde tyrosinekinaseremmers plaats, waarmee de ziekte bij het overgrote deel van de patiënten tot controle van de ziekte leidt. Helaas is het zo dat bij alle patiënten met CLL en ook bij een deel van de patiënten met CML na verloop van tijd de ziekte niet meer reageert op therapie. Dit wordt resistentie genoemd. Dit kan verschillende oorzaken hebben .Zo kunnen er in het DNA, erfelijke materiaal in de celkern, van (een deel van) de cellen veranderingen optreden, zogenaamde mutaties, waardoor therapieresistentie ontstaat. Het onderzoeken van deze mutaties kan nieuwe aangrijpingspunten voor therapie opleveren. Daarnaast kan de micro-omgeving van de kwaadaardige cellen een rol spelen bij therapieresistentie. Zoals wij bescherming zoeken in onze omgeving als we bedreigd worden, doet een kwaadaardige cel dat ook. Inzicht hierin levert hopelijk tevens nieuwe vormen van therapie op die de interactie tussen de kwaadaardige cel en de omgeving beïnvloeden. In het AMC vindt al jarenlang onderzoek plaats naar CLL en is de wens onderzoek te doen naar de genetische verandering die in de CLL cellen plaatsvindt, door een hele gevoelige techniek – DNA sequencing. In VUmc is een uniek model aanwezig waarin de rol van de menselijke omgeving van de kwaadaardige cel buiten het lichaam van de patiënt onderzocht kan worden. In dat muismodel kan dan direct het effect van therapie worden vastgesteld om zo te voorspellen welke therapie bij de patiënt het best werkzaam zal zijn. Hieronder worden de meer technische details van het onderzoek beschreven.
CLL PROJECT AMC
Prof. dr. Arnon P. Kater, Prof. dr. Erik F. Eldering, Prof. Dr. Marinus H. van Oers
Nieuwe mutaties bij chronische lymfatische leukemie: op weg naar een gerichte en geïndividualiseerde behandeling
- Achtergrondinformatie
- Chronisch Lymfatische Leukemie (CLL)
CLL is de meest voorkomende vorm van leukemie, met in Nederland 600 tot 700 nieuwe patiënten per jaar. CLL wordt gekenmerkt door een ophoping van kwaadaardige B lymfocyten in de bloedbaan, het beenmerg en de lymfklieren. Ook de lever en de milt zijn vaak geïnfiltreerd. De gemiddelde leeftijd waarop de ziekte zich presenteert is 65 jaar. Vanwege de vergrijzing zal het aantal patiënten toenemen, met de nodige klinische implicaties.
Het beloop van de ziekte verschilt van patiënt tot patiënt. Ongeveer 30% van de patiënten heeft een zeer mild ziektebeloop dat de levensverwachting niet beïnvloedt. Vijftien procent van de patiënten overlijdt echter binnen 2 à 3 jaar aan CLL-gerelateerde aandoeningen. De meerderheid van de patiënten heeft de eerste jaren weinig symptomen, maar ondervindt vervolgens ernstige problemen ten gevolge de ziekte. Tot op heden is de ziekte niet te genezen maar wel te behandelen met (immuno-) chemotherapie of met nieuwere, meer specifieke middelen.
- (Chemo)resistentie en nieuwe mutaties in CLL
Na chemotherapie, maar ook na behandeling met de nieuwe specifieke middelen ontstaat vroeg of laat resistentie, waarna de patiënt meestal snel overlijdt. Deze resistentie word in een deel van de patiënten verklaard door het ontstaan van specifieke mutaties in genen waarvan bekend is dat het de gevoeligheid voor chemotherapie beïnvloedt. De laatste jaren echter zijn met de modernste DNA analysetechnieken (de zgn. Next Generation Sequencing, NGS) nieuwe mutaties ontdekt in CLL cellen. De aanwezigheid van deze mutaties is gekoppeld aan een slechte prognose, om vooralsnog onbekende reden. Zeer recent onderzoek laat zien dat deze ongunstige mutaties in een zeer kleine fractie van de leukemiecellen aanwezig kunnen zijn, ook in een vroege fase van de ziekte. Aangezien de cellen met de mutaties niet of verminderd op de gegeven therapie zullen reageren worden deze cellen positief geselecteerd waardoor een resistente kloon overblijft. Betere kennis in de biologie van dergelijke mutaties kan tot nieuwe gerichtere behandeling leiden.
Een beter inzicht in het uitgroeien van cellen met bepaalde mutaties (variantklonen) in relatie tot (chemo)resistentie is cruciaal, niet alleen om patiënten een zware en niet-werkzame behandeling te besparen maar- nog belangrijker- om nieuwe gerichte behandelstrategieën te ontwikkelen.
- Doel van het project
Door middel van de nieuwe verfijnde NGS DNA analyse is het in principe mogelijk om op detail niveau te kijken welke (sub) kloons in de CLL cellen aanwezig zijn, bij diagnose en tijdens behandeling. Deze technieken zijn nu nog het domein van specialistische researchlaboratoria en zijn relatief duur. De verwachting is dat deze technieken binnen 5-10 jaar bij de patiënten diagnostiek in academische ziekenhuizen kunnen worden ingezet . Dit project beoogt deze periode aanzienlijk te bekorten en in het kader van de AMC/VUMC alliantie de nieuwste DNA analyse technieken over te brengen van research naar patiëntendiagnostiek. Zeer belangrijk is dat we door deze kennis nieuwe gerichte behandelstrategieën kunnen ontwikkelen en testen
- Uitvoering
In Europees verband (European Research Initiative on CLL; ERIC) wordt momenteel een begin gemaakt met systematische NGS DNA analyse van een 10-tal genen die herhaaldelijk gemuteerd blijken bij CLL, te weten ATM, SF3B1, NOTCH1, TP53, XPO1, POY1, BIRC3, MYD88, KLHL6, EGR2, NFKBIE en FBXW7. Het AMC team wil aansluiten bij deze aanpak, en zal hiertoe de vereiste materialen en technische kennis verwerven. De uitvoering van het project zal gedragen worden door onderzoekers uit de groep Kater/Eldering/van Oers in samenwerking met de afdeling Klinische Genetica van het AMC.
- Fase 1 2015 – opzetten van Next Generation Sequencing met bloedmonsters met bekende mutaties. Deze zijn aanwezig in onze CLL biobank.
- Fase 2 2016 – testen van onbekende bloedmonsters, vaststellen van technische limieten in samenhang met ERIC project
- Fase 3 2017 – implementeren van techniek volgens geldende (inter)nationale kwaliteitsnormen
- Budget
– Reagentia (custom made Illumina Miseq probes sets) €15.000
– NGS assays en data-analyse – €5000
CML PROJECT VUmc
Dr. Richard W. J. Groen, dr. Jeroen JWM Janssen, dr Anton C.M. Martens
Rol van de hematopoietische micro-omgeving bij de transformatie van chronische myeloïde leukemie naar blastencrisis
Achtergrond
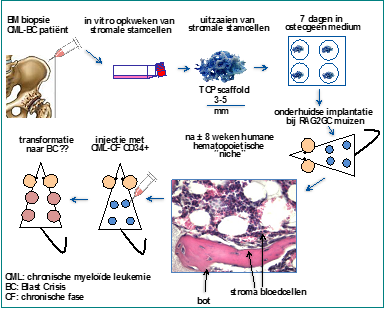
Ondanks het feit dat de huidige behandeling van patiënten met chronische myeloïde leukemie (CML) met imatinib en andere tyrosinekinaseremmers zeer effectief is, zijn er nog altijd patiënten waarbij de ziekte na verloop van tijd van een chronische fase naar een acute leukemie evolueert, de zogenaamde blastencrisis (BC). In hoeverre de hematopoietische micro-omgeving in het beenmerg bij dit proces een rol speelt is niet duidelijk. Het is niet alleen vanuit wetenschappelijk perspectief interessant om dit proces te begrijpen, maar het verkregen inzicht kan mogelijk ook bijdragen aan het verbeteren van de behandeling van CML. Tot voor kort was het nauwelijks mogelijk om hieraan specifiek onderzoek te verrichten, omdat er geen geschikte studiemodellen voorhanden waren. Daarin is verandering gekomen nu wij er in de afgelopen jaren in zijn geslaagd om een gehumaniseerd muizenmodel te ontwikkelen, waarmee het mogelijk is gebleken om bijna alle typen hematologische tumoren (waaronder acute leukemie, multipel myeloom en ook CML-blasten crisis) daarin te laten uitgroeien (Groen et al., Blood, 2012). Bovendien kunnen we de interactie tussen de hematopoietische (stroma-) micro-omgeving en leukemiestamcellen bestuderen. Dit werkt als volgt: stromale stamcellen, die geïsoleerd en opgekweekt worden uit normaal humaan beenmerg, worden op poreuze keramische partikels van tri-calciumphosphaat (TCP, 3-4 mm, de zogenaamde scaffolds) gezaaid en bij muizen onder de huid geplaatst. Deze muizen hebben een verzwakt afweersysteem, zodat ze de humane cellen niet afstoten. Na circa 8 weken hebben de stromale cellen binnenin de scaffolds een laagje humaan bot afgezet met daarop een netwerk van humane stromale cellen (zie de figuur hieronder). Dit geheel functioneert als een “humane niche”, een menselijke micro-omgeving. Als hier vervolgens leukemiecellen van acute leukemie-, CML-BC- of van multipel myeloom patiënten in worden geïnjecteerd gaan deze uitgroeien tot tumoren. Onze experimenten toonden aan dat de kenmerken van cellen in deze tumoren identiek waren aan de oorspronkelijke leukemiecellen van de patiënten terwijl ook het patroon van cytostaticaresistentie overeenkwam. Ook vanuit het CML-BC patiënten beenmerg bleken in de gehumaniseerde niche opnieuw CML-BC leukemie stamcellen geproduceerd te worden. Zo kan dus met dit model onderzocht worden hoe de kwaadaardige cellen in de patient zullen reageren op therapie. Op basis van deze ervaringen komen we tot de volgende vraagstelling.
Doelstelling
Het doel van dit project is om het gehumaniseerde scaffold model zodanig aan te passen dat we kunnen onderzoeken in hoeverre CML-CD34+ stamcellen uit beenmerg van chronische fase CML patiënten (CML-CF) een (versnelde) transformatie ondergaan, wanneer deze interactie hebben met stroma van CML-BC. De opzet is als volgt (en is hieronder schematisch weergegeven). Uit beenmergmonsters van CML CML-BC patiënten worden stromale stamcellen gekweekt en gezaaid op scaffolds, vervolgens in vitro aangezet tot differentiatie in de botrichting en daarna subcutaan bij muizen geïmplanteerd. In circa 8 weken zal zich in deze scaffolds een CML-BC hematopoietische omgeving vormen, bestaande uit humaan bot en humaan stroma. Op dat moment zullen er CD34+ stamcellen (afkomstig van chronische fase CML patiënten) in de gehumaniseerde CML-BC stroma scaffolds worden geïnjecteerd. Daarna worden de muizen regelmatig onderzocht op uitgroei van tumoren bij de scaffolds en het bloed van de muizen wordt onderzocht op de aanwezigheid van humane witte bloedcellen. Als er tumoren ontstaan zullen deze uitgebreid worden gekarakteriseerd. In de literatuur is gerapporteerd dat het stroma in het beenmerg van CML-BC patiënten veranderingen heeft ondergaan ten opzichte van het stroma in normaal beenmerg. In hoeverre deze veranderingen de oorzaak zijn voor de transformatie naar blasten crisis of dat dit een gevolg is van de transformatie naar blasten crisis is niet bekend. Indien wij aanwijzingen kunnen vinden dat de transformatie van CD34 CF naar BC versneld plaats vindt in het gehumaniseerde muizensysteem, dan hebben we daarmee het ideale model in handen om de factoren die hierbij een bepalende rol spelen te onderzoeken, zowel in het stroma als in de CML stamcellen. Daarmee kunnen we niet alleen inzicht krijgen in het verloop en transformatie van CML-CF naar BC, maar het zal ons ook een in vivo humaan modelsysteem bieden om nieuwe geneesmiddelen, die deze transformatie mogelijk kunnen voorkomen, op primair patiënten materiaal uit te testen.
Schematische opzet: De rol van de hematopoietische micro-omgeving in de transitie van
chronische fase CML naar blasten crisis.